张南同学想测定赤铁矿中氧化铁的质量分数,请回答有关问题.
测定方法如下:(假设赤铁矿中杂质不溶于水也不与酸反应).
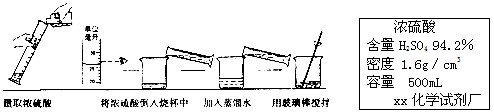
(1)配制硫酸.
①配制200g 19.6%的稀硫酸,需要标签上标注的浓硫酸的体积是______;(结果保留整数)
②上述实验过程中出现操作的错误是______.
(2)将赤铁矿粉末与稀硫酸混合,反应的化学方程式是______
(3)取20g的赤铁矿粉与150g 19.6%的稀硫酸恰好完全反应,求解生成硫酸铁质量(X)的比例式为______;
(4)此赤铁矿中氧化铁的质量分数为______;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是______.
(1)①设需要标签上标注的浓硫酸的体积是x
x?1.6g/cm3×94.2%=200g×19.6%
解得:x=26mL
②在稀释浓硫酸时应该将浓硫酸慢慢注入水中并不断搅拌,分析图中的过程可以知道图中的错误为先加入浓硫酸后加入水;
(2)赤铁矿中的主要成分为氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)150g19.6%的稀硫酸中含有硫酸的质量为:150g×19.6%=29.4g
设生成硫酸铁的质量为y,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294 400
z 29.4g y
=294 29.4g 400 y
解得:y=40g
(4)设赤铁矿中氧化铁的质量为z
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
160 294
z 29.4g
=294 29.4g 160 y
解得:z=16g
赤铁矿中氧化铁的质量分数为:
×100%=80%16g 20g
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是:
×100%=20%40g 150g+16g+34g
故答案为:(1)26mL;
②先加入浓硫酸后加入水;
(2)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(3)
=294 29.4g
;400 y
(4)80%;
(5)20%.
