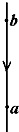现将10.6g 某碳酸钠样品与足量的稀盐酸反应,得到4.4gC02,(样品中的杂质可能是CaC03、K2C03、MgC03中的一种或两种),则下列情况合理的是( )
A.只含CaC03
B.可能含CaC03、MgC03
C.只含K2C03
D.可能含K2C03、MgC03
由题意可知,混合物与二氧化碳的比值是:
=10.6g 4.4g
,纯净的碳酸钠与二氧化碳的比值由方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O可知:106 44
,由此可知,混入的杂质与稀盐酸反应,杂质与二氧化碳的比值是:106 44
.106 44
A、由CaCO3+2HCl=CaCl2+CO2↑+H2O可知,碳酸钙与二氧化碳的比值为:
<100 44
.故A不符合题意;106 44
B、由MgCO3+2HCl=MgCl2+CO2↑+H2O可知,碳酸镁与二氧化碳的比值为:
<84 44
.综合A可知,含CaC03、MgC03的混合物与稀盐酸反应,混合物与二氧化碳的比值<106 44
.故B不符合题意;106 44
C、由K2C03+2HCl=2KCl+CO2↑+H2O可知,碳酸钾与二氧化碳的比值为:
>138 44
.故C不符合题意;106 44
D、由上述计算可知,含K2C03、MgC03的混合物与稀盐酸反应,混合物与二氧化碳的比值可能等于
.故D符合题意.106 44
故选D.