CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:
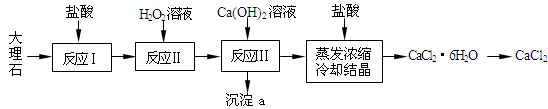
已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)反应Ⅰ中,需将大理石粉碎、搅拌,同时适当加热,其目的是: 。写出反应Ⅰ中主要反应的离子方程式: 。
(2)上述使用盐酸的浓度为10%,若用37%的浓盐酸来配制500mL的此盐酸所需的玻璃仪器有:玻璃杯、量筒、烧杯、胶头滴管、 。
(3)反应Ⅱ中的离子方程式: 。
(4)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为: ,若pH过大,则可能发生副反应的离子方程式: 。
(1)增大接触面积,加快反应速率(或提高浸取率,意思相近均给分)(2分)
CaCO3+2H+=Ca2++H2O+CO2↑(2分)
(2)500mL容量瓶(2分,不写规格得1分)
(3)2Fe2++2H++H2O2=2Fe3++2H2O
(4)Fe(OH)3、Al(OH)3(2分,各1分) Al(OH)3+OH—=AlO2—+2H2O(2分)
题目分析:(1)粉碎为增大接触面积,加热为加快反应速率;(2)配置溶液需用500mL容量瓶;(3)反应Ⅱ中加入双氧水是为了氧化亚铁离子为Fe3+,再调节pH除去;(4)溶液的pH约为8.0,Al3+、Fe3+均产生沉淀;氢氧化铝两性,若碱过量与碱反应溶解。