某化学小组进行Na2SO3的性质实验探究。
在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
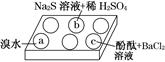
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
(1)a中实验现象证明Na2SO3具有________性。
(2)b中发生反应的离子方程式是_____________________________________________
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)__________________________________________________________。
(1)还原性 (2)SO32-+2S2-+6H+=3S↓+3H2O
(3)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入 BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。
HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入 BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去。
(1)a中发生反应的化学方程式为:Na2SO3+Br2+H2O=Na2SO4+2HBr,证明Na2SO3具有还原性。
(2)b中产生淡黄色沉淀,发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3H2O。
(3)滴入酚酞溶液变红是因为SO32-发生了水解反应而使溶液显碱性:SO32-+H2OHSO3-+OH-,再加入BaCl2溶液后,Ba2+与SO32-反应产生BaSO3沉淀,反应消耗了SO32-使其浓度减小,水解平衡向左移动,OH-浓度减小,红色褪去。
