氯化铵简称“氯铵”,又称卤砂,为无色晶体或白色结晶性粉末,易溶于水中,在工农业生产中用途广泛。以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
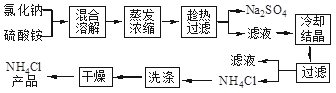
氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题:
(1)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(2)实验过程中趁热过滤的目的是 。
(3)写出“蒸发浓缩”时发生的化学方程式: 。
(4)某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。
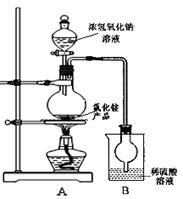
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是: ____ 。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液的离子反应方程式为 ,反应过程中NaOH一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.0gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
(1)蒸发皿
(2)防止氯化铵晶体析出而损耗
(3)(NH4)2SO4+2NaCl= Na2SO4↓+2NH4Cl
(4)①A、B装置间缺一个干燥装置 ② NH4++OH- NH3↑+H2O
NH3↑+H2O
使氯化铵充分反应完全转化为NH3 21.5%
题目分析:(1)实验室进行蒸发浓缩用到的主要仪器有蒸发皿、烧杯、玻璃棒、酒精灯等,
(2)由图像可以看出,在某一温度范围内,氯化铵的溶解度低于硫酸铵的溶解度,所以趁热过滤防止氯化铵晶体析出而损耗,可以使硫酸铵以沉淀形式滤出而氯化铵留在滤液里。
(3)蒸发浓缩时硫酸铵以固体形式存在,所以化学方程式为(NH4)2SO4+2NaCl= Na2SO4↓+2NH4Cl
△ 高温 |
