将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2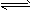 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率(用百分数表示)。
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
(1)bc
(2)消耗O2的物质的量:0.7 mol-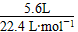 =0.45mol
=0.45mol
生成SO3的物质的量:0.45mol×2=0.9 mol
SO2和SO3的物质的量之和: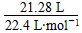 =0.95 mol
=0.95 mol
反应前SO2的物质的量:0.95mol
SO2的转化率: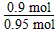 ×100%=94.7%
×100%=94.7%
(3)在给定的条件下,溶液呈强酸性,BaSO3不会存在。因此BaSO4的质量为
0.9 mol×0.05×233g·mol-1≈10.5g。

