乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。
(1)请写出乙二酸受热分解的化学方程式______________________。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。
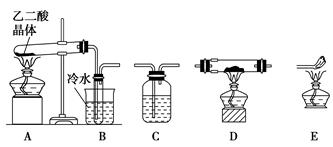
请你按整套装置从左至右的顺序填写下表中的空格:
| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | ||
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E |
(3)上述实验中能说明乙二酸受热分解生成了还原性气体的实验现象是________________________________________________________________。
(4)检验乙二酸具有较强的还原性,通常选用的试剂是_______________。
(1)H2C2O4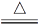 H2O+CO↑+CO2↑
H2O+CO↑+CO2↑
(2)
| 仪器符号 | 仪器中所加物质 | 装置作用 |
| B | 检验 H2O(g);冷却凝固乙二酸蒸汽,防止其进入C装置影响 CO2的检验。 | |
| C | 澄清石灰水 | 检验 CO2 |
| C | 吸收多余的 CO2 | |
| C | 浓硫酸 | 吸收水蒸气 |
| D | CuO或Fe2O3 | 检验CO |
| E | 处理CO尾气,防止污染空气 |
(3)D装置中的CuO由黑色变红色(或Fe2O3由红色变黑色),E装置导管口气体燃烧
(4)酸性高锰酸钾溶液或高锰酸钾
(2)根据分解方程式可知,需要检验H2O、CO和CO2三种气体,防止其他装置中水溶液的干扰,则应先检验H2O,装置D中为氧化铜,用来检验CO,CO还原氧化铜生成铜和CO2,防止生成的CO2对原CO2的干扰,则接着检验CO2,最后检验CO;(4)将乙二酸与强氧化性溶液反应,如酸性高锰酸钾溶液,若褪色,则证明乙二酸具有较强的还原性。
