某化学学习小组在实验室中探究铁钉与热浓硫酸的反应。其探究流程如图所示:
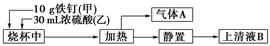
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”)。
(2)根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(3)上述流程图中从“静置”后的混合物中得到上清液B不能采用过滤的操作方法,其原因是__________________________________。
由于铁钉生锈,上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(4)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是________________(用化学方程式表示)。
利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是________(填仪器的字母代号),装置A的作用是____________________________,装置B中试剂X的化学式是________。
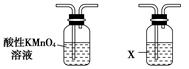
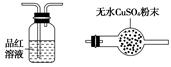
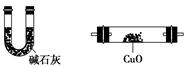
A B C D E F
(1)甲 (2)b
(3)浓硫酸会使滤纸炭化,从而使过滤失败 d
(4)C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O
A—C—B—E—F—D(或A—C—B—E—F—D—E,) 除去气体A中的SO2 Ca(OH)2或Ba(OH)2
(1)倾斜烧杯,加入铁钉后,沿烧杯内壁缓缓注入浓硫酸。如果先加入浓硫酸,再加铁钉,则容易溅起浓硫酸伤人。(2)浓硫酸为30 mL,已经超过规格为50 mL烧杯容量的1/3,加热时,浓硫酸容易溅出,而500 mL和1 000 mL烧杯容量较大,浓硫酸不能完全没及加入的铁钉,故应选取100 mL烧杯。(3)因为反应后的溶液仍为浓度较高的硫酸,用滤纸过滤,会导致滤纸炭化,从而使过滤失败;检验是否含有Fe2+,可利用其还原性,即加入酸性高锰酸钾溶液,观察溶液的紫色是否褪去。若选择a,无论是否含有Fe2+,溶液都会变为红色,因为溶液中已含有Fe3+;若选择b,则只能检验是
否含有Fe3+,先加入KSCN溶液,溶液变为红色,再加入铁粉,红色褪去;若选择c,即使含有Fe2+,生成的Fe(OH)3沉淀颜色较深,会掩盖Fe(OH)2沉淀的颜色,并且生成的Fe(OH)2沉淀也会迅速转化为红棕色的Fe(OH)3沉淀。(4)铁钉为碳和铁的合金,还可能发生C和浓硫酸的反应。检验CO2利用澄清石灰水或Ba(OH)2溶液,检验H2利用CuO和无水CuSO4粉末,由于SO2会对CO2的检验造成干扰,因此检验前要先除去SO2。

