(1)下列反应中属于氧化还原反应的是______.
A.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O; B.SO2+2H2S=2H2O+3S↓; △ .
C.Ba(OH)2+H2SO4=BaSO4↓+2H2O; D.Cl2+2NaOH=NaCl+NaClO+H2O.
(2)已知KMnO4 与浓盐酸发生如下反应:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.在上述反应中,氧化剂是______,氧化产物是______.用单线桥法标出此反应的电子转移方向和数目______.
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子.请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
______+______+______→______+______+______
②反应中1mol氧化剂得到______mol电子.
(1)A.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中Mn元素的化合价降低,Cl元素的化合价升高,则属于氧化还原反应; △ .
B.SO2+2H2S=2H2O+3S↓中S元素的化合价由+4降低为0,由-2升高到0,则属于氧化还原反应;
C.Ba(OH)2+H2SO4=BaSO4↓+2H2O中元素的化合价都没有变化,则不属于氧化还原反应;
D.Cl2+2NaOH=NaCl+NaClO+H2O中Cl元素的化合价由0降低为-1,由0升高到+1,则属于氧化还原反应;
故答案为:ABD;
(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,则KMnO4为氧化剂,HCl为还原剂,即Cl2为氧化产物,
在该反应中转移的电子为10e-,单线桥法标出此反应的电子转移方向和数目
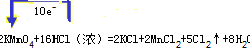
,
故答案为:KMnO4;Cl2;
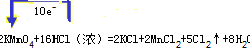
;
(3)①在反应中K2SO3失去电子,则氧化反应为K2SO3→K2SO4,在给出的物质中只有碘元素的化合价降低符合,则还原反应为KIO3→I2,由质量守恒定律可知,该反应在酸性条件下进行,则水为生成物,即反应物为K2SO3、H2SO4、KIO3,生成物为K2SO4、I2、H2O,故答案为:K2SO3;KIO3;H2SO4;I2;K2SO4;H2O;
②该反应中碘元素的化合价降低,则氧化剂为KIO3,1mol氧化剂得到电子为1mol×(5-0)=5mol,故答案为:5.
