过氧化钠(Na2O2)是一种化学性质活泼的淡黄色固体,在通常状况下能跟许多物质发生化学反应放出氧气.例如:2Na2O2+2CO2═2Na2CO3+O2↑,2Na2O2+4HCl=4NaCl+2H2O+O2↑,2Na2O2+2H2O=4NaOH+O2↑等.小红为了验证CO2跟Na2O2反应时产生的气体是氧气,设计了如下实验装置:
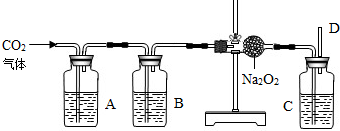
试回答:
(1)用石灰石和盐酸制取实验所用的CO2,设计A、B装置的目的是净化导入的CO2.其中A瓶内的液体是硝酸银溶液,其作用是______,所发生的化学反应方程式为______;B装置内液体应是______.
(2)C瓶内液体应是______.
(3)反应完毕,测得盛Na2O2的反应容器总质量增加了14g,则产生的氧气的质量为______g.
(1)A瓶内的硝酸银溶液可以与氯化氢气体发生复分解反应,除去混在二氧化碳气体中的氯化氢气体.故答:除去二氧化碳中的氯化氢气体;HCl+AgNO3=AgCl↓+HNO3;
除去二氧化碳气体中的水,通常选择浓硫酸.故答:浓硫酸;
(2)C瓶的作用除去生成的氧气中混有的二氧化碳,利用二氧化碳与碱溶液反应,通常选择可以吸收大量二氧化碳气体的氢氧化钠溶液.故答:氢氧化钠溶液;
(3)“盛Na2O2的反应容器总质量增加了14g”,质量增加的原因:容器中固体粉末吸收二氧化碳气体与放出氧气的质量差.假设产生氧气的质量为x,则吸收二氧化碳的质量为14g+x,根据化学方程式进行计算解出x值:
2Na2O2+2CO2═2Na2CO3+O2↑
88 32
14g+x x
=88 14+x
x=8g32 x
故答:8g.

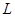 、质量为
、质量为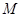 的车厢静止于光滑水平面上,车厢内有—质量为
的车厢静止于光滑水平面上,车厢内有—质量为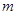 的物体以初速度
的物体以初速度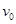 向右运动,与车厢来回碰撞
向右运动,与车厢来回碰撞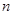 次后静止于车厢中,这时车厢的速度为( )
次后静止于车厢中,这时车厢的速度为( )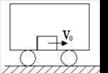
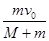 , 水平向右
, 水平向右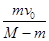 ,水平向右
,水平向右