某研究性学习小组通过下列实验探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,并制备硫酸铜晶体。完成下列填空。甲同学用装置I进行实验,加热反应物至沸腾,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
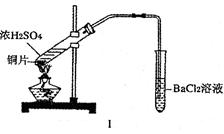
(1)白色沉淀是 。
(2)甲同学就白色沉淀的生成原因提出了两种假设,这两种假设可能是:
① ②
乙同学设计了改进装置Ⅱ进行实验,检验甲同学提出的假设(夹持装置和A中加热装置已略,气密性已检验)。
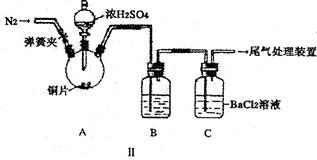
①打开弹簧夹,通入N2一段时间后关闭弹簧夹;
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
(3)操作①的目的是 ,集气瓶B中的试剂是 。
(4)该实验能否检验甲同学上述两种假设中的任意一种 ,理由是 。
丙同学向反应后的蓝色溶液中加入足量的CuO,过滤后将滤液制成硫酸铜晶体(CuSO4·xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如下:
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
(5)若无需再进行第三次称量,则a的数值范围应为 。
(6)若加热后坩埚与固体总质量为18.620g,计算x 的实测值 (保留二位小数),相对误差 。
(1)BaSO4(2分);
(2)①浓硫酸沸腾蒸出进入氯化钡溶液生成沉淀(1分)
②SO2被氧气氧化成硫酸生成沉淀(1分)
(3)排除装置内的空气(O2)(1分) 饱和NaHSO3溶液(1分)
(4)不能(1分),因为同时改变了两个变量,无法确定到底是哪个变量的作用。(1分)
(5)18.621±0.001 (1分)
(6)5.25 (2分) +5%(1分)
题目分析:(1)白色沉淀不溶于盐酸,因此白色沉淀是硫酸钡。
(2)根据硫酸的沸点和加热温度分析,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气,由于BaSO3能够溶于盐酸,根据元素守恒可知该沉淀只能是BaSO4,有可能一是挥发出的H2SO4提供的SO42-与Ba2+反应生成的,也有可能是溶液中溶解的氧气与SO2作用产生了硫酸,进而得到BaSO4;
(3)氮气性质稳定,排净装置中的空气中的氧气,以验证上述原理是否正确;为除去反应中带出的雾状硫酸,可以将气体通过饱和NaHSO3溶液;
(4)由于同时改变了两个变量,无法确定到底是哪个变量的作用。
(5)由于两次实验误差不能超过0.001,所以若无需再进行第三次称量,则a的数值范围应为18.621±0.001。
(6)若加热后坩埚与固体总质量为18.620g,因此失去的结晶水质量为22.700g -18.620g=4.08g,水的物质的量是0.227mol。晶体的质量为22.700g-11.710g=10.99g,则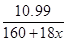 ×x=0.227
×x=0.227
解得x=5.25,因此相对误差为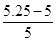 ×100%=5%。
×100%=5%。