某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。
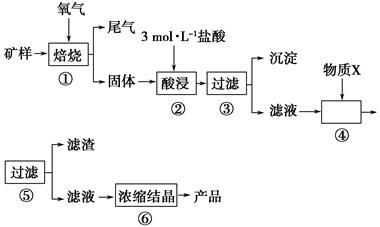
已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
回答下列问题:
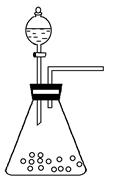
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质,用如图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:______________________、________________________;
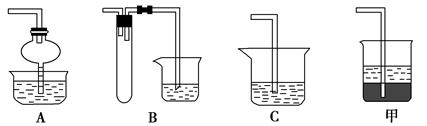
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中用碱液吸收处理,下列A、B、C装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是________。
(3)步骤②酸浸过程中,需要用到3 mol·L-1的盐酸100 mL,配制该盐酸时。除了用到烧杯、玻璃棒、胶头滴管外,还需要用到的仪器有________________。
(4)步骤④加入物质X的目的是______________________________________,物质X可以选用下列物质中的________。
A.氧化铜 B.稀盐酸
C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行________次过滤操作。
(1)2H2O2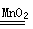 2H2O+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
2H2O+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
(2)AB 四氯化碳
(3)100 mL容量瓶、量筒
(4)调控溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出 A
(5)3
(1)结合装置可知该实验制取氧气的原理是固、液不加热制得氧气。因此可选用Na2O2与水反应或H2O2在MnO2催化作用下分解制取氧气。(2)焙烧过程中产生的大气污染物是SO2,用碱液吸收时要防止倒吸,故A、B、C装置中只能选用A、B装置;若选用甲装置,下层液体必是密度比水大的液态有机物(这样可防止倒吸),因此其下层液体可选用四氯化碳。(3)配制100 mL 3 mol·L-1的盐酸时用到的仪器有100 mL的容量瓶、量筒(量取浓盐酸)以及烧杯、玻璃棒、胶头滴管等。(4)依据实验目的和流程图可知在步骤④中加入X的目的是调节溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出;遵循除杂不引入新杂质的原则,结合选项可知加入的X最好为CuO。(5)在整个流程中,共用到3次过滤操作,即:除流程中给出的两次外,还有获得产品时要过滤一次。
