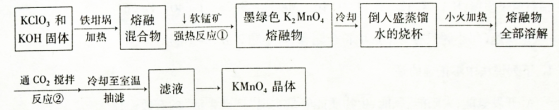
高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。下图是实验室制备的操作流程:
上述反应②的化学方程式:
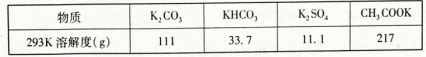
已知:
(1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是_______;
反应①的化学方程式为______。
(2)从滤液中得到KMnO4晶体的实验操作依次是________(选填字母代号,下同)。
A.蒸馏 B.蒸发 C.灼烧 D.抽滤 E.冷却结晶
(3)制备过程中需要用到纯净的CO2气体。制取纯CO2净最好选择下列试剂中_________。
A.石灰石 B.浓盐酸 C.稀疏酸 D.纯碱
(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是______ 。
(5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
(1)高温下强碱要腐蚀坩埚(瓷坩埚的主要成分是硅酸盐,含有二氧化硅,要与碱反应。)3MnO2+KClO3+6KOH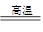 3K2MnO4+KCl+3H2O(2)B E D (3)C D(4)KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5)A(因为盐酸有还原性;醋酸钾的溶解度比硫酸钾大很多,蒸发浓缩时基本上都会留在母液里)
3K2MnO4+KCl+3H2O(2)B E D (3)C D(4)KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5)A(因为盐酸有还原性;醋酸钾的溶解度比硫酸钾大很多,蒸发浓缩时基本上都会留在母液里)
题目分析:(1) 加热软锰矿、KClO3和KOH固体混合物时,由于KOH会与瓷坩埚中的SiO2发生反应:2KOH+SiO2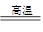 K2SiO3+H2O腐蚀坩埚,而不与Fe发生反应,所以要用铁坩埚。根据题意可知反应①的化学方程式为3MnO2+KClO3+6KOH
K2SiO3+H2O腐蚀坩埚,而不与Fe发生反应,所以要用铁坩埚。根据题意可知反应①的化学方程式为3MnO2+KClO3+6KOH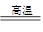 3K2MnO4+KCl+3H2O 。 (2)从滤液中得到KMnO4晶体的实验操作依次是蒸发浓缩、冷却结晶、抽滤。因此选项为B、E、D。(3)制备过程中需要用到纯净的CO2气体,酸应该用不挥发性的酸——H2SO4,但是H2SO4与CaCO3发生反应产生CaSO4微溶于水,覆盖在CaCO3的表面,是反应不能再进行。所以盐应该用Na2CO3.选项为C、D。(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5) 若把实验中通CO2改为加其他的酸,因为有挥发性,不能选用,K2SO4的溶解度比CH3COOK小的多,因此综合考虑应该选择醋酸得到的产品纯度更高。故选项为A。
3K2MnO4+KCl+3H2O 。 (2)从滤液中得到KMnO4晶体的实验操作依次是蒸发浓缩、冷却结晶、抽滤。因此选项为B、E、D。(3)制备过程中需要用到纯净的CO2气体,酸应该用不挥发性的酸——H2SO4,但是H2SO4与CaCO3发生反应产生CaSO4微溶于水,覆盖在CaCO3的表面,是反应不能再进行。所以盐应该用Na2CO3.选项为C、D。(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。原因是KHCO3的溶解度比K2CO3小很多,滤液蒸发浓缩时KHCO3会随KMnO4一起结晶析出。(5) 若把实验中通CO2改为加其他的酸,因为有挥发性,不能选用,K2SO4的溶解度比CH3COOK小的多,因此综合考虑应该选择醋酸得到的产品纯度更高。故选项为A。
