某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)两同学利用下图所示装置进行测定:
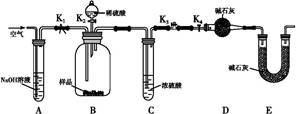
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。若未进行步骤 ,将使测量结果偏低。
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为 。
(3)丙同学认为还可以通过测量CO2的体积并测量 来测定沉淀中CuCO3的质量分数。
(1)Cu2+ + 2HC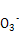 =uCO3↓+ CO2↑+ H2O
=uCO3↓+ CO2↑+ H2O
(2)②防止空气中CO2和水蒸气进入装置D ③ cab b
④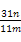 ×100%
×100%
(3)样品质量(或样品充分灼烧后的质量)(其他合理答案也可)
(1)如果甲的观点正确,则生成碳酸铜的同时,必然还生成CO2和水,离子方程式为Cu2+ + 2HC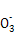
 CuCO3↓+CO2↑+ H2O。
CuCO3↓+CO2↑+ H2O。
(2)②由于空气中也含有水蒸气和CO2,所以E中碱石灰的作用是防止空气中的CO2和水蒸气进入装置D,干扰实验结果。
③由于装置中也含有空气,所以首先要排尽装置中的空气,然后再反应。由于反应中生成的气体会残留在装置中,因此反应结束后,再通入空气将反应生成的气体全部排出,因此正确的答案选cab。如果不进行b步骤,必使CO2的量偏小,将使测量结果偏低。
④D是吸收CO2的,所以碳酸铜的质量是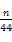 ×124 g,所以碳酸铜的质量分数是
×124 g,所以碳酸铜的质量分数是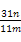 ×100%。
×100%。
(3)由CO2的体积可计算CuCO3的物质的量,还必须直接或间接测得样品的质量。
