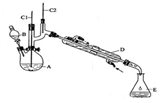
实验室合成环己酮的反应、装置示意图及有关数据如下:
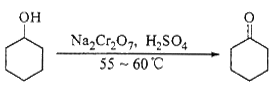
环己醇、环己酮、饱和食盐水和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 |
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
①如何滴加酸性Na2Cr2O7溶液 ,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~ 156℃馏分,b.过滤,c.在收集到的馏分中加NaCl固体至饱和,静置,分液,d.加入无水MgSO4固体,除去有机物中少量水。
①上述操作的正确顺序是 (填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
(1)①打开分液漏斗颈上的玻璃塞,拧开下面的活塞,缓慢滴加
避免使用致癌危险的Na2Cr2O7
②环已酮和水形成具有固定组成的恒沸物一起蒸出
(2)①c d b a ②漏斗、分液漏斗 ③ 增加水层的密度,有利于分层,减小产物的损失
(3)3
题目分析:(1)①从酸式滴定管中滴加酸性Na2Cr2O7溶液的方法是打开分液漏斗颈上的玻璃塞,拧开下面的活塞,缓慢滴加。用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化环己醇制环己酮,用漂粉精和冰醋酸氧化突出的优点是 避免使用致癌危险的Na2Cr2O7。安全系数更大。②由于环已酮和水形成具有固定组成的恒沸物一起蒸出。所以蒸馏不能分离环己酮和水的混合物。(2)①操作的正确顺序是首先在收集到的馏分中加NaCl固体至饱和,静置,分液,然后加入无水MgSO4固体,除去有机物中少量水。接着过滤,最后蒸馏,收集151~ 156℃馏分即得到纯净的环己酮。因此顺序代号为:c d b a 。②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有漏斗、分液漏斗。③在上述操作c中,加入NaCl固体的作用是增加水层的密度,有利于分层,减小产物的损失。(3)环己酮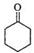 分子为对称结构,在分子中含有羰基碳原子的邻位、间位、对位三种种不同化学环境的氢原子。
分子为对称结构,在分子中含有羰基碳原子的邻位、间位、对位三种种不同化学环境的氢原子。
