问题
计算题
工业上制硫酸的主要反应如下:
4FeS2+11O2高温2Fe2O3+8SO2 2SO2+O2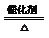 2SO3
2SO3
SO3+H2O=H2SO4。
用黄铁矿可以制取H2SO4,再用H2SO4可以制取化肥(NH4)2SO4。煅烧含 FeS2 80.0% 的黄铁矿 80.0 t,最终生产出 83.6 t (NH4)2SO4。已知 NH3的利用率为 92.6%,H2SO4的利用率为 95.0%,试求黄铁矿制取H2SO4时的损失率。
答案
37.5%
首先须搞清 H2SO4的利用率与 FeS2利用率的关系。并排除 NH3利用率的干扰作用。
其次,根据 S 原子守恒找出已知量 FeS2与未知量(NH4)2SO4的关系(设黄铁矿的利用率为x):
FeS2 ~ 2H2SO4 ~ 2(NH4)2SO4
120 264
80.0 t×80.0%×95.0%·x 83.6 t
x=62.5%
黄铁矿的损失率为:1.00-62.5%=37.5%。
注: (1)原料利用率(或转化率) = 实际投入原料总量(或转化原料量) ×100%
(2)产物产率 =  ×100%
×100%
(3)中间产物的损耗量(或转化率、利用率)都可归为起始原料的损耗量(或转化率、利用率)
(4)元素的损失率=该化合物的损失率
