(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。
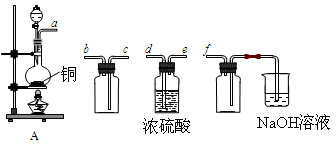
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
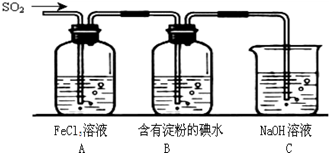
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
A.烧瓶
B.酒精灯
C.漏斗
D.烧杯 E.玻璃棒(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是______,原因是___________________________________。
(5)能表明的还原性性弱于SO2的现象是________________________________________。
I.(1)d→e→c→b (2)Cu+2H2SO4(浓)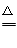 CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
(3)将气体通入品红溶液,溶液褪色,加热恢复原色
Ⅱ.(1)溶液颜色由黄色逐渐变为浅绿色;1:2
(2)吸收SO2,防止SO2污染环境; (3)A
(4)①; SO2过量,SO2可使酸性KMnO4溶液褪色 (5)B中蓝色褪去
题目分析:I.(1)SO2密度比空气大,用向上排空气法收集,收集前需要浓硫酸干燥,最后还需要用氢氧化钠溶液吸收,因此正确的连接顺序为a→d→e→c→b→f。
(2)浓硫酸具有强氧化性,在加热的条件下与铜发生氧化还原反应,反应的化学方程式为Cu+2H2SO4(浓)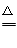 CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。
(3)SO2具有漂白性,因此检验SO2的方法是:将气体通入品红溶液,溶液褪色,加热恢复原色。
Ⅱ.(1)氯化铁具有氧化性,能把SO2氧化生成硫酸,而铁离子被还原为亚铁离子,因此装置A中的实验现象是:溶液颜色由黄色逐渐变为浅绿色;A中反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,因此参加反应的SO2和Fe3+的物质的量之比等于计量数之比,即为1:2。
(2)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫,故答案为:
(3)蒸发使用仪器有蒸发皿、酒精灯、玻璃棒;过滤使用仪器有漏斗、烧杯、玻璃棒,因此没有用到的仪器是烧瓶,答案选A。
(4)Fe2+使高锰酸钾溶液褪色,但实验中SO2是过量的,而二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫也能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,因此方案①不合理。
(5)根据反应I2+SO2+2H2O=2HI+H2SO4可知,二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,因此能表明的还原性性弱于SO2的现象是B中蓝色溶液褪色。2的制备、性质实验探究等
