问题
实验题
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为______________________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是__________________;原因是________________________________________________________________________________________________________________________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________(用a、b……填写)。
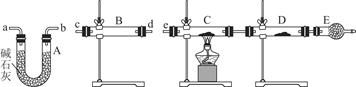
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | |||
| C | CuO固体 |
答案
(1)Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
(2)氢气和水蒸气 随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,同时会有少量水蒸气
(3)cd(或dc) ab(或ba) e
(4)
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | 无水硫酸铜 | 固体由白色变成蓝色 | SO2中含有水蒸气 |
| C | 固体由黑色变成红色 | SO2中含有氢气 |
(3)要检验SO2中的水蒸气以及氢气,需首先用无水硫酸铜检验水蒸气,且用碱石灰除去水蒸气,再将剩余气体依次通过灼热的氧化铜和无水硫酸铜,通过黑色氧化铜变红和无水硫酸铜变蓝的现象证明气体中含有氢气,最后将剩余气体用盛有碱石灰的干燥管吸收,防止污染空气。
