(17分)Na2SO3固体在空气中久置容易变质 。
(I)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为 。
(II)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质; 假设2:Na2SO3样品完全没有变质;假设3: 。
补充完成以下实验过程及现象和结论,完成探究。
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 离子,假设1不成立。 ②褪色的离子方程式为: 。 |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 ; 结论:假设2成立。 |
| …… | …… |
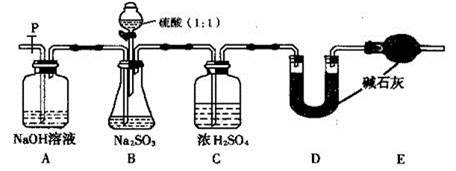
检查B装置气密性的操作为 。
(2)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(3)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处(填图中字母)装置实验前后的质量差。
(I) 2Na2SO3+ O2 ==2Na2SO4。
(II)假设3: Na2SO3部分变质 。①SO32-离子, ②5SO32-+2MnO4-+ 6H+ =5SO42- +2Mn2++3H2O;
③现象:若加盐酸产生气体,加BaCl2无白色沉淀生成 ;
(III)(1) 关闭开关P和分液漏斗活塞,往C中加水至淹没导管口,微热B,C导管口有气泡冒出,停止加热一会儿后导管中形成倒吸的水柱,则气密性良好。
(2) 将装置中的SO2全部排入U形管中吸收。 (3) D 。
题目分析:(I)在Na2SO3中S的化合价为+4价,容易被空气中的氧气氧化为+6价的Na2SO4.反应的方程式是2Na2SO3+ O2 ==2Na2SO4。(II)根据题目已经给定的知识可知:假设3是Na2SO3部分变质;①H2SO4酸化的KMnO4溶液有强氧化性,能与还原性的离子发生反应而褪色;结论:样品中有SO32-离子;证明假设1不成立。②发生褪色的离子方程式为:5SO32-+2MnO4-+ 6H+ =5SO42- +2Mn2++3H2O;另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液;③若加盐酸产生气体,加BaCl2无白色沉淀生成,就证明含有SO32-和SO42-离子.假设2成立。(III)(1)检查B装置气密性的操作为关闭开关P和分液漏斗活塞,往C中加水至淹没导管口,微热B,C导管口有气泡冒出,停止加热一会儿后导管中形成倒吸的水柱,则气密性良好。(2)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是将装置中的SO2全部排入U形管中吸收,以减小实验误差。(3)除已称量的a g Na2SO3样品外,实验中还应测定的数据是D处U形管吸收气体前后的质量差值。
