过氧化尿素是一种新型漂白、消毒剂,漂白、消毒效果优于H2O2和过氧乙酸,某工业用过氧化尿素的部分参数列于下表。
| 分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75—85℃ | 500g·L—1 |
合成过氧化尿素的流程及反应器的示意图如下:
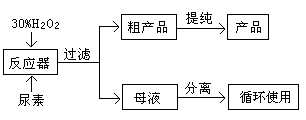
请回答下列问题:
(1)写出合成过氧化尿素的化学方程式: 。
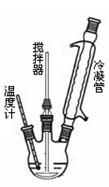
(2)反应器里冷凝管中冷水从 (填“上”或“下”)口流入;反应器的加热方式是 。
①直接加热;②水浴加热;③蒸气浴加热;④冰浴
(3)搅拌器选用的材料是玻璃而不是铁质或铝质材料的原因是 ,
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是 。
(5)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
完成并配平下列化学方程式:
MnO4—+ H2O2+ H+= Mn2++ H2O+ 
②KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分数为 。
(1)CO(NH2)2+H2O2=CO(NH2)2·H2O2(用可逆号也可)(2分)
(2)下,②(各1分,共2分)
(3)铁铝易被(过氧化氢)腐蚀,(2分)
(4)降低蒸馏温度,防止过氧化氢分解(2分,答上一个原因给1分。此题的评分要点是减压蒸发,冷却结晶回答与否不作为采分点。)
(5)①2 5 6 2 8 5O2(2分,只写上O2给1分) ②酸式 偏高(各1分,共2分)
③不合格,(2分)12%(2分)
题目分析:(1)根据过氧化尿素分子式即可写出化学方程式:CO(NH2)2+H2O2=CO(NH2)2·H2O2;
(2)冷凝管起冷凝回流的作用,冷却水从下口进入,冷却效果好;根据CO(NH2)2·H2O2熔点75—85℃,所以采用的加热方式应用水浴加热,易于控制温度;
(3)过氧化氢具有弱酸性,可以和铁铝反应;
(4)从母液中分离出H2O2和尿素,采用的是减压蒸发、冷却结晶的方法,其原因是降低蒸馏温度,防止过氧化氢分解;
(5)①反应中MnO4-是氧化剂,H2O2是还原剂,氧化产物是O2;依据元素化合价变化,锰元素化合价从+7价变化为+2价,过氧化氢中的氧元素化合价从-1价变化为0价,根据电子守恒配平写出离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2,故答案为:2;5;6;2;8;5O2;
②KMnO4溶液具有强氧化性,能将碱式滴定管下端的橡胶管氧化,所以不能用碱式滴定管量取,可以用酸式滴定管量取,若滴定前滴定管尖嘴处有气泡,滴定后消失,依据反应的关系可知,测得标准液体积偏大,结果偏高,故答案为:偏高;
③依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;
2MnO4 -~5H2O2;
2 5
0.0060L×0.1000mol·L-1 0.00150mol
250mL容量瓶中含过氧化氢0.0150mol;
过氧化氢质量分数=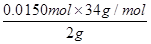 ×100%=25.5%
×100%=25.5%
活性氧16%,相当于H2O234%,则活性氧质量分数=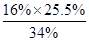 =12%<16%,
=12%<16%,
故答案为:12%;根据滴定结果确定产品质量不合格;
