以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成份为Fe(CrO2)2]为主要原料生产重铬酸钠晶体( Na2Cr2O7·2H2O)的主要工艺流程如下:
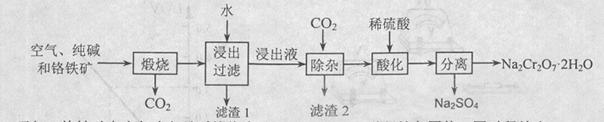
己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3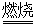 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为____。
(2)滤渣1的成分为________,滤渣2的成分为____。
(3)将滤渣l放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是 。
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mo1/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀 ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
②还原法: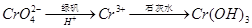 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是 。
(1)+3(1分)
(2)Fe2O3 Al(OH)3(各1分)(其它合理答案也可)
(3)取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+(其它合理答案也可)(2分)
(4)2 Al2O3 4Al + 3O2↑(1分)
4Al + 3O2↑(1分)
(5)①2.4×10-4(2分)②CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O(3分)
(6)Fe2(SO4)3 + 3KClO + 10KOH = 2K2FeO4 + 3K2SO4 + 3KCl + 5H2O(3分)
题目分析:(1)在铬铁矿Fe(CrO2)2中,Fe的化合价为+2,所以Cr的化合价为+3,
(2)含杂质的铬铁矿经煅烧、溶于水后,只有氧化铁不溶于水,作为滤渣除去,所以滤渣1的成分是Fe2O3,此时溶液为Na2CrO4和 NaAlO2的混合液,通入CO2气体会和NaAlO2反应产生Al(OH)3,所以滤渣2的成分是Al(OH)3,
(3)将滤渣l放入稀硫酸溶解后得溶液W Fe2(SO4)3,检验Fe3+的方法是取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红,证明有Fe3+
(4)工业上用电解熔融氧化铝的方法来得到铝,化学方程式为2 Al2O3 4Al + 3O2↑,
4Al + 3O2↑,
(5)①Ksp(BaCrO4)=1.2×10-10,c(CrO42-)<=5.0×10-7 mo1/L,所以c(Ba2+)>=1.2×10-10/5.0×10-7=2.4×10-4 mo1/L, ②酸性条件下 CrO42-与绿矾FeSO4▪7 H2O反应,CrO42-作氧化剂,绿矾作还原剂,其离子方程式为CrO42-+3Fe2++8H+=Cr3++3Fe3++4H2O
(6)W 为Fe2(SO4)3,以溶液Fe2(SO4)3、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是Fe2(SO4)3 + 3KClO + 10KOH = 2K2FeO4 + 3K2SO4 + 3KCl + 5H2O
