溴乙烷是一种重要的化工合成原料。实验室合成溴乙烷的反应和实验装置如下:
反应:CH3CH2OH+HBr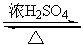 CH3CH2Br+H2O
CH3CH2Br+H2O
装置:
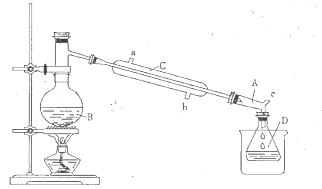
实验中可能用到的数据如下表:
| 物质 | 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
①合成反应:在仪器B中加入适量NaBr、浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物。
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷。
回答下列问题:
(1)仪器B的名称是___________。
(2)仪器C为直形冷凝管,冷水进口是___________(填“a”或“b”)。
(3)仪器D置于盛有_________的烧杯中,目的是__________________________________。
(4)装置A的名称为牛角管,其结构中的c支管的作用是___________________________。
(5)溴乙烷粗产品分离提纯阶段,加水的目的是___________________________________。
(6)该实验所得溴乙烷的产率为 ________________________。
(1)蒸馏烧瓶
(2)b
(3)冰水混合物 冷却溴乙烷
(4)平衡装置D 装置B中的气压,便于装置D接受溜出液
(5)除去溶解在溴乙烷中的乙醇
(6)78.9%或79%或78.89%
题目分析:(1)仪器B的名称是蒸馏烧瓶;(2)为了使冷凝效果更好,仪器C直形冷凝管,冷水进口是b.热水出口为a。(3)溴乙烷的沸点为38.4°,为了收集产品,要把仪器D置于盛有冰水混合物的烧杯中,以冷却溴乙烷。(4)装置A的名称为牛角管,其结构中的c支管的作用是平衡装置D、装置B中的气压,便于装置D接受溜出液。(5)由于乙醇的沸点只有78.4°,在加热时容易发生反应而随着溴乙烷蒸出。乙醇与水混溶,而溴乙烷不能溶解于水,所以在溴乙烷粗产品分离提纯阶段,加水就可以除去溶解在溴乙烷中的乙醇,便于混合物的分离。(6)n(乙醇)="(" 50mL×0.79g/ml)÷46g/mol=0.8587mol;n(溴乙烷)= (52mL×1.42g/ml)÷109g/mol=0.6774mol.所以该实验所得溴乙烷的产率为(0.6774÷0.8587)×100%=78.9%.

