(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验

(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。

(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
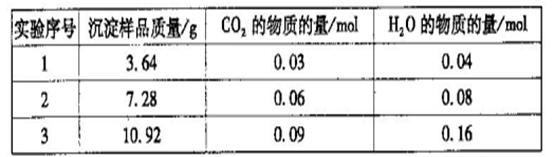
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O
(1)沉淀溶解,有气泡产生(2分)
(2)取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀。(2分,或取最后一次洗涤液,用焰色反应检验存在的钠离子。答案合理即可得分) (3)>(2分)
(4)先通入一会儿空气,再加热(2分) (5)防止空气中的水蒸气和CO2进入装置D(2分)
(6)3(1分) c(2分)
题目分析:(1)碳酸镁与稀盐酸反应生成氯化镁、水和CO2,因此实验现象是沉淀溶解,有气泡产生。
(2)由于沉淀表面有吸附的氯离子,所以可以通过检验氯离子来判断沉淀是否洗涤干净,即取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀即证明没有洗涤干净。
(3)由于氢氧化镁的溶度积常数小于碳酸镁的溶度积常数,所以Ksp(MgCO3)>Ksp [Mg(OH)2]。
(4)由于装置中有残留的空气,而空气中通过碱石灰时水蒸气和CO2被吸收,所以因此先通入一会儿空气,再加热。
(5)由于空气中还含有水蒸气和CO2会进入装置D干扰实验,所以E装置中碱石灰的作用是防止空气中的水蒸气和CO2进入装置D。
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去。根据表中数据可知CO2与水蒸气的物质的量之比是3:4,则a.Mg2(OH)2CO3·3H2O中CO2与水蒸气的物质的量之比是1:4,a不正确; b.Mg(OH)2(CO3)2·3H2O中CO2与水蒸气的物质的量之比是1:2,b不正确;c.Mg4(OH)2(CO3)3·3H2O中CO2与水蒸气的物质的量之比是3:4,c正确;d.Mg5(OH)4(CO3)3·2H2O中CO2与水蒸气的物质的量之比是3:4,但3.64g该物质得不到0.03molCO2,d不正确,答案选c。
