Fe、Mg、Al 三种金属分别跟稀盐酸充分反应,得到相同质量的氢气,其原因是:①Fe、Mg、Al的质量相等,盐酸足量;②Fe、Mg、Al的质量比是56:24:27,盐酸足量;③Fe、Mg、Al的质量比是28:12:9,盐酸足量;④Fe、Mg、Al均为过量,所用盐酸的质量分数和质量都相同.你认为可能的原因是( )
A.③④
B.①②
C.①③
D.②③
①因为产生氢气的是盐酸中的氢离子,故参与反应的HCl的质量相等,产生的氢气的质量就相等.故④符合;
②假设Fe、Mg、Al 三种金属分别跟稀盐酸充分反应,得到氢气的质量都是2g,
设参与反应的Fe的质量为x,Mg的质量为y,Al的质量为z,
Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,
56 2 24 2 54 6
x 2g y 2g z 2g
∴
=56 2
,x 2g
=24 2
,y 2g
=54 6
,z 2g
解之得:x=56g,y=24g,z=18g,
故Fe、Mg、Al的质量比为:56g:24g:18g=28:12:9.
故③符合;①②不符合;
故选A.

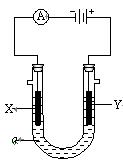
 池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则: