工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
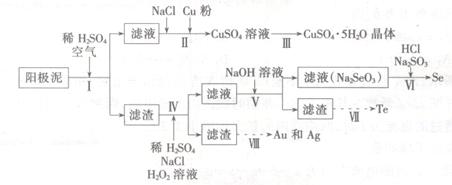
已知:①阳极泥的主要化学成分,如表1所示
表一
| 主要成份 | Cu Ag Au Se Te |
| 百分含量/% | 23.4 12.1 0.9 6.7 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| 固定浸出温度 | 固定H2SO4浓度 | |||
| H2SO4浓度 mol/L | 浸出率/% | 浸出温度/℃ | 浸出率/% | |
| Cu Ag Au Se Te | Cu Ag Au Se Te | |||
| 4 | 95.1 4.67 <0.2 0.83 8.93 | 30 | 87.1 4.58 <0.2 0.08 6.83 | |
| 3 | 94.5 4.65 <0.2 0.28 6.90 | 40 | 94.5 4.65 <0.2 0.28 6.90 | |
| 2 | 78.1 2.65 <0.2 0.05 2.85 | 50 | 96.1 5.90 <0.2 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为 ;此过程中H2O2溶液的添加量要远远高于理论值,原因为 。
(5)步骤Ⅵ中所发生反应的化学方程式为 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 B.浓盐酸 C.浓氢氡化钠溶液 D.王水
(1)2Cu+O2+2H2SO4=2CuSO4+2H2O 硫酸浓度3 mol·L-1、浸出温度40℃
(2)除去滤液中的Ag+
(3)加热浓缩(蒸发)、冷却结晶、过滤
(4)氧化滤渣中的硒和碲,使其进入溶液中,增加硒和碲的浸出率。H2O2会有部分分解。
(5)Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O
(6)TeO32-+4e-+3H2O=Te+6OH-
(7)A
题目分析:(1) 步骤I的主要过程中发生的主要反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O.由表2数据可知:硫酸的浓度越大,Cu浸出率越高。在硫酸的浓度不变时,温度越高Cu浸出率越高。但是浓度太高,杂质Se、Te的浸出率也越高;温度越高,Ag、Se、Te的浸出率也越高。综合考虑纯度、能耗等,最合适的条件是硫酸浓度3 mol/L、浸出温度40℃.(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为利用AgCl的不溶性来除去滤液中的杂质离子Ag+。(3)步骤Ⅲ从硫酸铜溶液中得到硫酸铜晶体的操作方法为加热浓缩(蒸发)、冷却结晶、过滤。(4)步骤Ⅳ中,加入H2O2溶液的作用为把滤渣中的硒和碲氧化为离子,使其进入溶液中,增加硒和碲的浸出率。此过程中H2O2溶液的添加量要远远高于理论值是因为H2O2不稳定,受热容易分解,有H2O2会有部分发生了分解反应。(5)根据过程示意图及氧化还原反应的特征与实质,可知步骤Ⅵ中所发生反应的化学方程式为Na2SeO3+2Na2SO3+2HCl=Se+2Na2SO4+2NaCl+H2O。(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,Te应该在阴极得到。其阴极的电极反应式为TeO32-+4e-+3H2O=Te+6OH-。(7)因为Au与常见的试剂都不能发生反应。而Ag则能与硝酸反应得到硝酸银溶液。所以步骤Ⅷ中得到的Au和Ag混合物可以用硝酸溶解,然后进行过滤分离。选项为A。
