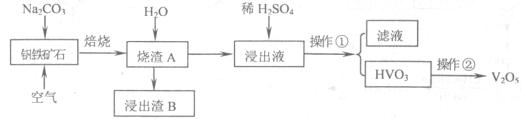
工业上常用含少量Al2O3的钒铁矿(FeO·V2O5)碱熔法提取V2O5。简要流程如下:
已知:①焙烧时Al2O3和V2O5都能与纯碱反应,生成相对应的钠盐,同时放出CO2气体
②常温下物质的溶解度:NaVO3~21.2g/l00g水;HVO3~0.008g/l00g水
请回答:(1)请写出钒铁矿焙烧时,V2O5与纯碱反应化学方程式____ 。
“浸出渣B”的主要成分可能是① ;②_ ___ ;③_ ___;④____ 。(写化学式,可不填满)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是____ 。
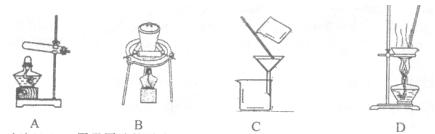
(3)“操作①”包括 、洗涤、干燥。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是____ 。(填序号)
(4)NaVO3用于原油的脱硫技术,由V2O5溶于热NaOH溶液中制取,反应的离子方程式为____ 。
(1)V2O5 +Na2CO3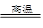 2NaVO3 +CO2 (2分)
2NaVO3 +CO2 (2分)
Fe2O3或Fe3O4,或者Fe2O3和Fe3O4 (3分)
(2)H2SO4与NaVO3反应生成难溶的HVO3,HVO3包裹在一些烧渣的表面,阻碍了反应的进行,从而降低了HVO3产率,且使产生的HVO3不纯。另外,铁的氧化物会和硫酸反应生成铁离子,增加干扰离子,消耗硫酸,浪费资源。(3分)
(3)过滤(1分)Na+、Al3+(2分)B (2分)
(4)V2O5 +2OH- 2VO3-+ H2O (2分)
2VO3-+ H2O (2分)
题目分析:(1)根据V2O5能与纯碱反应,生成相对应的钠盐,同时放出CO2气体,得其化学方程式为V2O5 +Na2CO3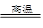 2NaVO3 +CO2,在焙烧的过程中FeO被氧化为Fe2O3或Fe3O4,所以“浸出渣B”的主要成分可能是①Fe2O3②Fe3O4、③Fe2O3和Fe3O4
2NaVO3 +CO2,在焙烧的过程中FeO被氧化为Fe2O3或Fe3O4,所以“浸出渣B”的主要成分可能是①Fe2O3②Fe3O4、③Fe2O3和Fe3O4
(2)若直接加入硫酸,则A中的铁的氧化物与硫酸反应增加干扰离子,消耗硫酸,浪费资源;同时H2SO4与NaVO3反应生成难溶的HVO3,HVO3包裹在一些烧渣的表面,阻碍了反应的进行,从而降低了HVO3产率,且使产生的HVO3不纯。
(3)加入硫酸后产生难溶的HVO3,所以需过滤出来;该过程中硫酸与偏铝酸钠反应最终生成铝离子,所以若不洗涤沉淀,则可能含有Na+、Al3+,操作②是把HVO3进行受热分解得V2O5,所以应选择B装置;
(4)V2O5溶于热NaOH溶液中,产物之一是NaVO3,不难推测另一产物是水,所以反应的离子方程式为
V2O5 +2OH- 2VO3-+ H2O
2VO3-+ H2O
