问题
问答题
用锌与硫酸溶液反应,五次实验结果记录如下:
| 实验序号 | 锌的质量/g | 硫酸溶液的质量/g | 在实验条件下氢气的体积/L |
| l | 6.5 | 200 | 2.30 |
| 2 | 13.0 | 200 | 4.60 |
| 3 | 19.5 | 200 | 6.90 |
| 4 | 26.0 | 200 | 9.20 |
| 5 | 32.5 | 200 | 9.20 |
(1)根据表中数据画出氢气的体积随锌的质量变化的关系图.
(2)求硫酸溶液中H2SO4的质量分数.
(3)根据表中数据简要说明第4次实验中H2SO4和Zn恰好完全反应的理由.
答案
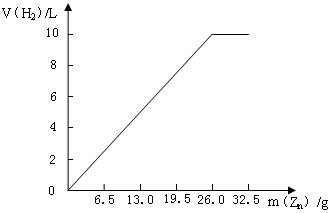
(1)如右图
(2)设与26.0g Zn反应的H2SO4的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 98
26.0g x
=65 26.0g 98 x
x=39.2g
硫酸溶液中H2SO4的质量分数为:
×100%=19.6%39.2g 200g
答:硫酸溶液中H2SO4的质量分数为19.6%
(3)第5次实验中氢气的体积与第4次实验中氢气的体积相等,说明第4次实验中 恰好完全反应; 前3次实验中Zn完全反应,第4次实验中Zn的质量与第1(或2、3)次实验中Zn的质量之比等于第4次实验中的体积与第1(或2、3)次实验中的体积之比,说明第4次实验中Zn恰好完全反应.
故答案为:第5次实验中氢气的体积与第4次实验中氢气的体积相等,说明第4次实验中 恰好完全反应; 前3次实验中Zn完全反应,第4次实验中Zn的质量与第1(或2、3)次实验中Zn的质量之比等于第4次实验中的体积与第1(或2、3)次实验中的体积之比,说明第4次实验中Zn恰好完全反应.
