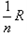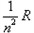问题
问答题
某稀盐酸溶液50克与6.9克纯净的K2CO3 固体恰好完全反应,请计算:
(1)反应后生成二氧化碳多少克?
(2)该盐酸溶液中溶质的质量分数是多少?
(3)欲将上述溶质质量分数的原盐酸溶液50克稀释成5%的稀盐酸,需要加水多少克?
答案
(1)设生成的二氧化碳的质量为x,盐酸溶液中溶质的质量为y.
K2CO3+2HCl=2KCl+H2O+CO2↑
138 73 44
6.9g y x
= 138 44 6.9g x
=138 73 6.9g y
x=2.2g y=3.65g
答:可生成二氧化碳的质量为2.2g
(2)盐酸溶液中溶质的质量分数=
×100%=7.3% 3.65g 50g
答:原稀盐酸溶液中溶质的质量分数为7.3%.
(3)设需加水的质量为z
3.65g=(50g+z)×5%
z=23g
答:需加水23克.

 ,ρ为正比例常数,则并联后的电阻应为[ ]
,ρ为正比例常数,则并联后的电阻应为[ ]