某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
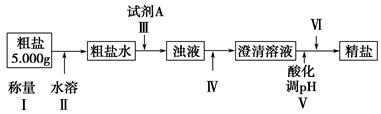
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
A.烧杯 B.试管 C.玻璃棒 D.分液漏斗 E.漏斗 F.酒精灯
G.蒸发皿
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是___________________________________
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是___________________________________
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤 B.蒸发、浓缩 c.萃取、分液 D.冷却、结晶
(1)ACE (2)BaCl2溶液 Na2CO3溶液
(3)取所得溶液的上层清液于试管中,再滴入少量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量 (4)盐酸 在酸性条件下,会有部分沉淀溶解,从而影响精盐的纯度 (5)bda
(1)操作Ⅳ是过滤。(2)除杂试剂是过量的,为了除去过量的Ba2+,需要在加入BaCl2溶液之后加入Na2CO3溶液。(3)BaCl2过量后,溶液中不存在SO42—,取上层清液加入BaCl2溶液后不会产生沉淀。(4)加入的Na2CO3溶液是过量的,加入盐酸调节溶液的pH即可除去CO32—,得到纯净的食盐水。若在过滤前酸化,则在酸性条件下,会有部分沉淀溶解,从而影响精盐的纯度。(5)从食盐水得到食盐晶体需要经过蒸发、浓缩、冷却、结晶、过滤、洗涤等过程。
