Na2SO3、SO2是中学常见的物质。
(1)某同学用下图示装置制取干燥纯净的SO2。
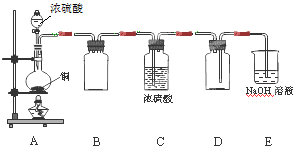
写出制取SO2气体的化学方程式 。请指出D装置中的错误 。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。 | ,证明待测液中含Br-。 |
| 步骤② | 在试管B中加入少量待测液,
| 有白色沉淀生成, 证明待测液中含SO42-。 |
| 步骤③ | 在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。 | , 证明待测液中含SO32-。 |
(1)Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O(2分) 进气管比出气管短(2分)
CuSO4 + SO2↑+ 2H2O(2分) 进气管比出气管短(2分)
立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液 (2分)
(2)
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 溶液分层,下层呈橙红色(2分) | |
| 步骤② | 加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液(2分) | |
| 步骤③ | 新制饱和溴水(2分) | 溴水褪色(2分) |
题目分析:(1)根据题给装置图分析,制取SO2气体的原理是铜和浓硫酸共热生成硫酸铜、二氧化硫和水,化学方程式为Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
CuSO4 + SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
