问题
填空题
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是______,氧化产物是______.
(3)当生成0.5mol的 NO时,反应转移电子是______mol,同时还原的硝酸为______克.
答案
(1)(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为
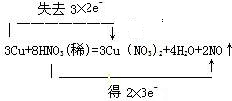
,故答案为:
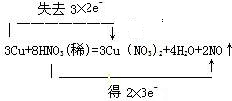
;
(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物,
故答案为:HNO3,Cu(NO3)2;
(3)根据化学方程式,当生成2molNO时,转移的电子为6mol,消耗硝酸8mol,在8mol硝酸中,只有2mol硝酸被还原,即被还原的硝酸是参加反应硝酸的量的
,所以当生成0.5mol的NO时,反应转移电子是1.5mol,消耗硝2mol,被还原的硝酸是0.5mol,质量是0.5mol×63g/mol=31.5g,故答案为:1.5,31.5.1 4
