某研究性学习小组对还原铁粉与水蒸气的反应产物进行科学探究。已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃:根据下图所示实验装置,进行了还原铁粉与水蒸气的反应实验,实验中观察到肥皂液中产生了大量的气泡。
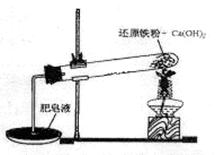
(1)实验中Ca(OH)2的作用是 。实验中产生的气体产物是 。
(2)为进一步探究还原铁粉与水蒸气反应固体产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体,针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:固体为Fe3O4
假设三:
①限选用下列试剂:盐酸、KSCN溶液、K3Fe(CN)6 溶液、氯水,证明假设一不成立
| 操作 | 现象 | 结论 |
| 假设一不成立 |
②为了进一步确定产物的成分,用黑色固体进行了下列实验:

加入足量氯水所发生反应的离子方程式是 ;检验红褐色固体是否洗涤干净的操作是 ;灼烧时盛放固体的仪器是 ;若假设二成立,黑色固体最终全部转化成的红棕色粉末的质量是 g
(1)提供反应所需的水蒸气 H2
(2)固体为Fe3O4和FeO
| 操作 | 现象 | 结论 |
| 取适量固体于试管中,加入盐酸加热溶解,再加入KSCN溶液,振荡 | 溶液出现红色 |
2Fe2++Cl2=2Fe3++2Cl- 取最后一次洗涤液于试管中,再用稀硝酸酸化,再加入AgNO3溶液,若没有浑浊,则洗涤干净。 坩埚 6.
题目分析:(1)Fe与水蒸气反应应得到的是铁的氧化物和H2。因此,反应物水蒸气可以有580℃以上高温分解Ca(OH)2得到.(2)因为氧化铁是红色,而产物是黑色,故产物固体为FeO或Fe3O4或二者的化合物三种情况。①当实验证明固体产物有+3价铁时,假设一不成立。实验操作是取适量固体于试管中,加入盐酸加热溶解,再加入KSCN溶液,振荡,溶液出现红色。②固体产物用盐酸溶解后,加入氯水可将Fe2+氧化为Fe3+(2Fe2++Cl2=2Fe3++2Cl-)。红褐色固体Fe(OH)3中吸附了少量NaCl,用水洗涤2~3次,取最后一次洗涤液于试管中,再用稀硝酸酸化,再加入AgNO3溶液,若没有浑浊,则洗涤干净。固体灼烧的仪器是坩埚。
由Fe3O4~ 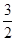 Fe2O3,5.8g Fe3O4产生6g Fe2O3。
Fe2O3,5.8g Fe3O4产生6g Fe2O3。
