问题
选择题
一定质量的氯化铜和40g盐酸组成的混合溶液中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的关系如图所示,下列判断中正确的是( )
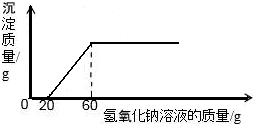
A.最终生成沉淀的质量为14.7g
B.40g盐酸的溶质的质量分数是27.375%
C.生成沉淀的质量随氢氧化钠溶液的滴加而逐渐增多
D.当加入的氢氧化钠溶液为60g时,所得溶液为氯化钠溶液
答案
A、设生成沉淀的质量为x,则:
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
80 98
40g x20%=8g x
=80 8g 98 x
解得:x=9.8g
故A错.
B、设盐酸的质量分数为y,则:
NaOH+HCl═NaCl+H2O
40 36.5
20gx20% 40g?y
=4g
=40 4g 36.5 40g ? y
解得:y=9.125%
故B错.
C选项说的不严密,一开始加入氢氧化钠溶液不会产生沉淀,到最后把氯化铜消耗完之后,也不会再产生沉淀故 C错
D由上分析中所发生的两个化学反应及图可知,加入60g氢氧化钠溶液时,恰好把氯化铜和盐酸消耗掉,所以最后所得溶液中的溶质只有氯化钠也就是氯化钠溶液,故D正确.
故选D
