工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
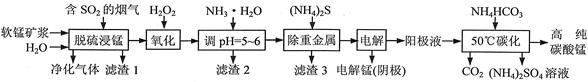
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为 。
(2)“滤渣2”中主要成分的化学式为 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 。
(4)“电解”时用惰性电极,阳极的电极反应式为 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3; ; 。
(1)MnO2+SO2=MnSO4
或H2O+SO2 =H2SO3、MnO2+H2SO3=MnSO4+H2O(2分)
(2)Fe(OH)3、Al(OH)3(2分)
(3)Na2S会增大回收的(NH4)2SO4中Na+含量(2分)
(4)2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O(2分)
(5)Mn2++2HCO3- MnCO3↓+CO2↑+H2O(2分)
MnCO3↓+CO2↑+H2O(2分)
NH4HCO3与H+反应,防止MnCO3沉淀溶解损失;NH4HCO3受热分解损失(2分)
三氯异氰尿酸“有效氯”含量=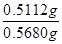 ×100%=90%(1分)
×100%=90%(1分)
题目分析:(1)该反应的反应物为二氧化硫和二氧化锰产物为硫酸锰;(2)反应经过三次除杂,一次是氧化除去亚铁离子,第三次是除去重金属得到纯净溶液,故第二次应除去铁铝杂质生成氢氧化物;(3)使用Na2S会引入杂质钠离子;(4)电解硫酸锰和硫酸铵溶液,阴极产生锰,阳极氢氧根离子放电产生氧气,4OH--4e-=O2↑+2H2O;(5)该反应的反应物为碳酸氢铵和硫酸锰,产物是碳酸锰,Mn2++2HCO3- MnCO3↓+CO2↑+H2O;电解时溶液中产生氢离子溶液为酸性,会溶解碳酸盐,故加入过量碳酸氢铵反应调节溶液酸碱性,防止MnCO3沉淀溶解损失;碳酸氢铵不稳定受热易分解,故需多加试剂弥补分解损失。
MnCO3↓+CO2↑+H2O;电解时溶液中产生氢离子溶液为酸性,会溶解碳酸盐,故加入过量碳酸氢铵反应调节溶液酸碱性,防止MnCO3沉淀溶解损失;碳酸氢铵不稳定受热易分解,故需多加试剂弥补分解损失。

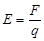
 适用于任何电场
适用于任何电场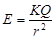 知,当r→0时电场强度趋近于无限大
知,当r→0时电场强度趋近于无限大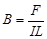 知,一小段通电导体在某处不受磁场力,说明此处一定无磁场
知,一小段通电导体在某处不受磁场力,说明此处一定无磁场