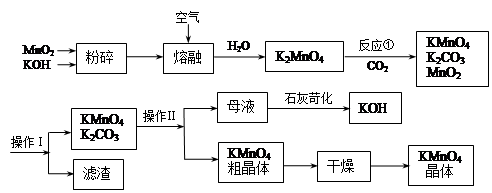
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
(1)写出实验室利用KMnO4分解制取O2的化学方程式
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
A.84消毒液(NaClO溶液)
B.双氧水
C.苯酚
D.75%酒精(3)在滴定实验中,常用 (填“酸式”或“碱式”)滴定管量取KMnO4溶液。
(4)写出反应①的化学方程式
(5)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填
性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(6)上述流程中可以循环使用的物质有 、 (写化学式),鉴于此现用100吨软锰矿(含MnO287.0%),理论上可生产KMnO4晶体 吨(不考虑制备过程中原料的损失)。
(1)2KMnO4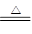 K2MnO4+MnO2+O2↑ (2分)
K2MnO4+MnO2+O2↑ (2分)
(2)AB (各1分,共2分,选错不得分)
(3)酸式 (2分)
(4)3K2MnO4+2CO2 = 2KMnO4+2K2CO3+MnO2(2分)
(5)过滤(1分) 溶解度(1分) 浓缩结晶(1分)
(6)MnO2(1分) KOH(1分) 158(2分)
题目分析:(1)实验室利用KMnO4分解制取O2的化学方程式2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(2)KMnO4稀溶液是一种常用的消毒剂,其消毒原理是利用了它的强氧化性。所以与高锰酸钾消毒原理相同的是A、84消毒液,利用了次氯酸的强氧化性,正确;B、双氧水具有强氧化性,正确;C、苯酚是利用了渗透作用使细菌蛋白质变性,错误;D、75%酒精是利用了渗透作用使细菌蛋白质变性,错误,答案选AB。
(3)因为高锰酸钾具有强氧化性,所以用酸式滴定管量取;
(4)根据所给产物,写出反应①的化学方程式3K2MnO4+2CO2 = 2KMnO4+2K2CO3+MnO2
(5)将溶液与固体分离,用过滤的方法,所以操作1为过滤;KMnO4和K2CO3两物质在溶解度上操作差别,K2CO3的溶解度更大,所以利用溶解度的不同,采用浓缩结晶,趁热过滤得到高锰酸钾胶体;
(6)从流程图中可看出,MnO2与KOH开始消耗,后又生成,所以可循环使用;二者循环使用,可认为二氧化锰全部转化为高锰酸钾,即MnO2~KMnO4,软锰矿中MnO2的质量是87吨,所以可生成KMnO4的质量是158吨。