早在春秋战国时期,我国就开始生产和使用铁器.铁矿石冶炼成铁是一个复杂的过程.
(1)在实验室里,可以利用图A、B两套装置将氧化铁还原成铁:
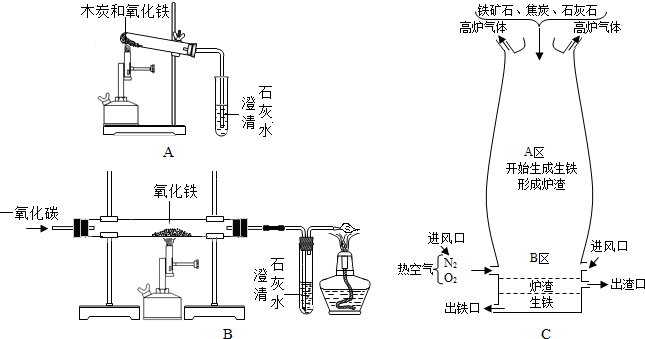
①装置A中,木炭和氧化铁反应的化学方程式为______,该反应所属基本反应类型为______反应;澄清石灰水中发生反应的化学方程式为______.
②装置B中,应先______(选填“通一氧化碳”或“加热氧化铁”);装置末端的酒精灯能将一氧化碳转化为无毒的二氧化碳,一氧化碳有毒是因为______.
(2)图C是教材中炼铁高炉及炉内化学变化过程示意图:
①若采用的铁矿石主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:
A区:______
B区:______
②要炼出含铁96%的生铁3000t,至少需要含氧化铁90%的赤铁矿石的质量是多少?
(1)①木炭具有还原性可以将氧化铁还原成铁,同时生成二氧化碳,该反应的化学方程式为:3C+2Fe2O3
4Fe+3CO2↑,该反应为置换反应; 高温 .
②一氧化碳不但具有还原性,还具有可燃性,当混有了空气时在加热或是点燃的条件下容易发生爆炸,所以实验前应该先通入一氧化碳;一氧化碳有毒,一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合,从而使人中毒;
(2)①依据A区主要是生成铁的反应,所以方程式为:Fe2O3+3CO
2Fe+3CO2;而B区主要是产生一氧化碳共发生了两个反应,方程式为:C+O2 高温 .
CO2,CO2+C 点燃 .
2CO; 高温 .
②设需要赤铁矿石的质量为x.
Fe2O3+3CO
2Fe+3CO2 高温 .
160 112
90%?x 3000t×96%=2880t
=160 112 90%?x 2880t
解得:x=4571.4t.
答:至少需要含氧化铁90%的赤铁矿石的质量是4571.4t.
故答案为:(1)①3C+2Fe2O3
4Fe+3CO2↑;置换;CO2+Ca(OH)2═CaCO3↓+H2O; 高温 .
②通一氧化碳;一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能再与氧气结合;
(2)①3CO+Fe2O3
2Fe+3CO2;CO2+C 高温 .
2CO; 高温 .
②4571.4t.
