辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
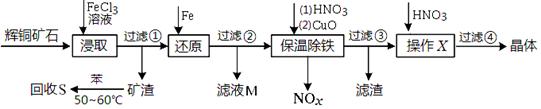
(1)写出步骤“还原”中可能发生反应的离子方程式 、 。
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该物质的化学式为 ;向滤液M中加入(或通入)下列 (填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.盐酸
(4)保温除铁过程中加入CuO的目的是 、 ;
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体。
硝酸的作用是 ;
操作X是 、 (填操作名称) 。
(1)Fe +2Fe3+→3Fe2+ Fe +Cu2+→Cu+Fe2+
(2)温度高苯容易挥发,温度低溶解速率小
(3)HNO3 (1分) b (2分)
(4)调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀
(5)抑制Cu2+的水解(1分) 蒸发浓缩、冷却结晶(2分)
题目分析:(1)辉铜矿与氯化铁溶液反应生成氯化铜、氯化亚铁和单质硫,二氧化硅不反应与单质硫一起形成矿渣,滤液中含有铁离子、铜离子,所以加入铁粉反应的反应有Fe +2Fe3+→3Fe2+ 、Fe +Cu2+→Cu+Fe2+。
(2)苯是有机溶剂,易挥发,所以温度高苯容易挥发,而温度低溶解速率小,因此回收S过程中温度控制50℃~60℃之间,不宜过高或过低。
(3)气体NOx与氧气混合后通入水中能生成硝酸,所以可循环利用的物质化学式为HNO3。滤液M是氯化亚铁,可以再转化为氯化铁而循环利用,所以该试剂应该是氯气,答案选b。
(4)氧化铜是碱性氧化物,能与酸反应调节溶液的pH值,所以氧化铜的作用是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀而析出。
(5)硝酸铜溶液中的铜离子易水解,所以加入硝酸的作用是抑制Cu2+的水解;从溶液中得到硝酸铜晶体的实验操作应该是蒸发浓缩、冷却结晶。