三苯甲醇(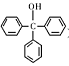 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。

已知:(I)格氏试剂容易水解:
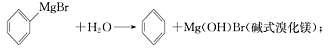
(Ⅱ)相关物质的物理性质如下:
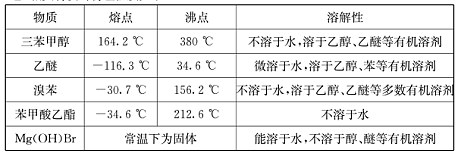
(Ⅲ)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点。
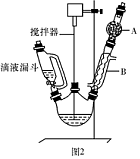
请回答以下问题:
(1)图2中玻璃仪器B的名称: ;装有无水CaCl2的仪器A的作用是 。
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持微沸,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:

其中,①操作为: ;洗涤液最好选用 (从以下选项中选择);
A.水
B.乙醚
C.乙醇
D.苯检验产品已经洗涤干净的操作为: 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL。则产品中三苯甲醇的质量分数为 。
(1)冷凝管(2分) 防止空气中的水蒸气进入装置,使格式试剂水解(2分)
(2)平衡压强,便于漏斗内试剂滴下 (2分) 水浴(2分)
(3)蒸馏或分馏 (2分) A (2分) 取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净(2分)
(4)90% (2分)
题目分析:(1)图2中玻璃仪器B的名称是冷凝管,B的作用是防止空气中的水蒸气进入装置,使格式试剂水解;
(2)使用滴液漏斗使上下气体压强相同,保证液体顺利滴下;
(3)三苯甲醇粗产品中含有乙醚、溴苯、苯甲酸乙酯等有机物,三苯甲醇的沸点最高,所以先用蒸馏的方法除去有机杂质,碱式溴化镁溶于水不溶于有机溶剂,所以洗涤液选用水A;检查洗涤是否干净的一般步骤是:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净;
(4)由2-OH~H2,可计算出三苯甲醇的物质的量是0.1008L/22.4L/mol×2=0.009mol,所以产品中三苯甲醇的质量是0.009mol×260g/mol="2.34g," 则产品中三苯甲醇的质量分数为2.34g/2.60g×100%=90%。
