(15分)工业中利用废铜(含有锌、铝等)制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L—1计算)。
| 开始沉淀的pH | 沉淀完全的pH | 沉淀溶解的pH | |
| Cu2+ | 4.4 | 6.4 | |
| Al3+ | 3.0 | 5.0 | 10 |
| Zn2+ | 5.9 | 8.9 | 11 |
②由表可知Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2—,请写出金属锌与氢氧化钠溶液反应的离子方程式
(2)为了符合绿色化学的要求,某研究性学习小组进行如下设计:
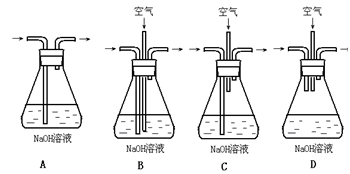
第一组:空气为氧化剂法
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知:Ksp[Fe((OH)3]≈10-38,然后过滤、浓缩、结晶。
请回答下列问题:
①方案为了使铁离子全部沉淀,应调节pH至少为 。
②方案中甲物质可选用的是
A.CaO B.NaOH C.CuCO3 D.Cu2(OH) 2CO3 E.Fe2(SO4) 3
③方案中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将铜粉放到 1.5 mol·L-1的足量稀硫酸中,控温在50℃加入10%的足量H2O2反应0.5 h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 。
请回答下列问题:
④用过氧化氢为氧化剂法比流程中采用硝酸和硫酸溶解的优点是 。
⑤用少量95%的酒精淋洗的目的是 。
(3)废铜溶解后经过一系列操作得到硫酸铜溶液,补充完整由溶解液制备纯净硫酸铜溶液的实验步骤 。
(1) ①3∶2 B
② Zn+2OH-+2H2O=[Zn(OH)4]2—+H2↑
(2)①3
②CD
③4Fe2++O2+4H+===4Fe3++2H2O;2Fe3++Cu===2Fe2++Cu2+
④减少硫酸铜晶体的溶解损失
⑤ 产物是水,无污染
(3)向溶液中加氢氧化钠溶液至pH为11,充分反应过滤洗涤,向沉淀中加适量稀硫酸溶解,制的硫酸铜溶液。
题目分析:(1)①铜与稀硫酸不反应,加入硝酸做氧化剂使铜溶解,反应为3Cu+3H2SO4+2HNO3=3CuSO4+2NO+4H2O,,由方程式知硫酸和硝酸的物质的量之比最佳为3:2;NO不能被氢氧化钠直接吸收,需先与氧气反应生成二氧化氮,在与氢氧化钠反应,故选B装置。②锌与强碱反应生成[Zn(OH)4]2—同时应生成氢气;(2)①根据Ksp[Fe((OH)3]计算,pH至少为3;②加入甲物质是使铁离子沉淀出来,同时不能引入新的杂质,加入不溶于水但与酸反应的铜的化合物,促进铁离子水解生成氢氧化铁沉淀而除去,故选用CuCO3、Cu2(OH) 2CO3 、CuO、Cu(OH)2等。③通入的氧气把亚铁离子氧化为铁离子,铁离子能与铜反应而使其溶解;④硫酸铜晶体溶于水,洗涤时需用饱和硫酸铜溶液或乙醇(盐不易溶解于有机溶剂),降低其溶解损失;⑤双氧水是绿色氧化剂,产物是水无污染;(3)根据信息可以根据铝、锌的氢氧化物溶解于强碱,调节pH得到氢氧化铜沉淀,然后加硫酸溶解制的硫酸铜溶液。