问题
问答题
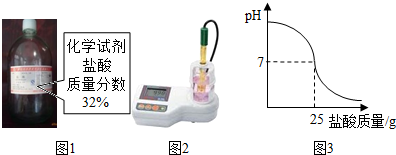
为测定标示质量分数为32%的盐酸(图1)的实际质量分数,小明用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).发生反应的化学方程式为:NaOH+HCl=NaCl+H20.
(1)请以此次测定的结果,列式计算该盐酸的实际质量分数;
(2)请分析你的计算结果与标签标示的质量分数不一致的可能原因.
答案
(1)氢氧化钠和盐酸生成氯化钠和水,所以氢氧化钠和盐酸恰好完全时溶液的PH等于7,既20克氢氧化钠溶液和25克盐酸恰好完全反应.NaOH的质量=20克×40%=8克,设盐酸中的溶质的质量是X.
NaOH+HCl=NaCl+H2O
40 36.5
8克 X
═40 36.5 8克 X
得:X=7.3克
∴盐酸的溶质的质量分数=
×100%═29.2%.7.3克 25克
(2)盐酸具有挥发性,所以溶液的中的溶质逐渐减少,溶剂不变,因此稀盐酸的浓度逐渐变稀.故答案为:盐酸具有挥发性.
答:盐酸的实际质量分数为29.2%.
