(15分)
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d.不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的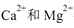 都看作
都看作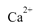 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的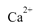 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟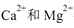 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
A.将水加热煮沸 B.加入适量的Na3P04
C.加入过量的稀盐酸 D.将水通过磺化煤
(4)工业上采用硫化钠一石灰铁盐法除去含砷废水(砷的主要存在形式为H3ASO3的主要工艺
流程如下
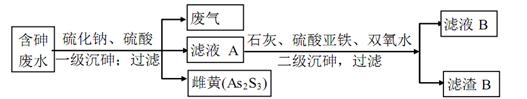
已知:a.亚砷酸(H3As03)还原性较强,易被氧化为砷酸(H3AsO3)
B.亚砷酸盐的溶解性大于相应的砷酸盐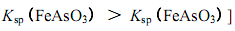
请回答以下问题:
①废气的主要成分为____
②写出一级沉砷过程中生成雌黄的离子方程式:______
③滤渣B的主要成分有_____〔写两种,用化学式表示)
(15分)
(1)吸附(2分) 过滤(2分)
(2)33.6º(或33.6度) (2分) 不符合(1分)
(3)ABD(3分)
(4)① H2S(1分)
②2H3AsO3+3S2‾+6H+=As2S3↓+6H2O (2分)
③FeAsO4、Ca3(AsO4)2、Ca3(AsO3)2、Fe(OH)3、CaSO4(2分,其中任意两者均可)
题目分析:(1)活性炭具有较大的表面积,具有吸附性;杂质沉降后,通过过滤可除去杂质。
(2)25.0毫升水中含Ca2+和Mg 2+的总物质的量为0.0100mol/L×0.0150L=1.50×10-4mol,折合成CaO的质量为1.50×10-4×56=8.40×10-3g,所以水的硬度为8.40×10-3×1000/25×1000/10=33.6º;因硬度超过25º,故不符合饮用水标准。
(3)A、将水加热煮沸,Ca(HCO3)2分解生成CaCO3沉淀,Ca2+浓度减小,正确;B、加入适量的Na3P04,PO43‾与Ca2+反应生成Ca3(PO4)2沉淀,Ca2+浓度减小,正确;C、加入过量的稀盐酸,HCl与Ca(HCO3)2反应生成CaCl2,易溶于水,错误;D、将水通过磺化煤,Ca2+被吸收,Ca2+浓度减小,正确。
(4)①反应物中含有硫化钠和硫酸,所以废气的主要成分为H2S。
②含砷废水含有H3ASO3,在酸性环境下与S2‾发生反应生成雌黄As2S3,同时生成H2O,配平可得离子方程式:2H3AsO3+3S2‾+6H+=As2S3↓+6H2O
③加入了石灰和硫酸亚铁,可生成Fe(OH)3、CaSO4沉淀,加入了强氧化剂双氧水可生成FeAsO4、Ca3(AsO4)2、Ca3(AsO3)2等沉淀。
