利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下:
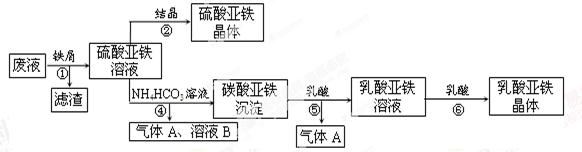
请回答:
(1)步骤①中分离操作的名称是______;步骤⑥必须控制一定的真空度,原因是_________;
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2•xH2O)的化学方程式为__________;步骤④的离子方程式为_____________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1KMnO4溶液20.00mL,则所得晶体中FeSO4•7H2O的质量分数为(以含a的式子表示)_____________________。

该题是目的是生成乳酸亚铁和硫酸亚铁.
(1)步骤①中得到滤渣和硫酸亚铁溶液,其操作是过滤。步骤⑥必须控制一定的真空度,其主要原因是,有利于水分的蒸发,以,防止Fe2+被氧化。
(2)由于是水解,必然水是反应物,另外已知了产物,TiO2•xH2O,根据守恒方知另一产物是硫酸。这样就可以写水解方程式TiOSO4+(x+1)H2O=TiO2•xH2O+H2SO4。
(3))FeCO3存在着溶解平衡,这样乳酸电离出的H+就会影响平衡向正方向移动;
(4)由化合价升降守恒,就可把方程式配平。由方程式找出Fe2+与MnO4-的计算计量数关系,方可进行计算:
W(FeSO4•7H2O=(0.10000mol/L×0.02L×5×5×278g/mol)÷ag=13.9/a
