某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O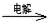 MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。
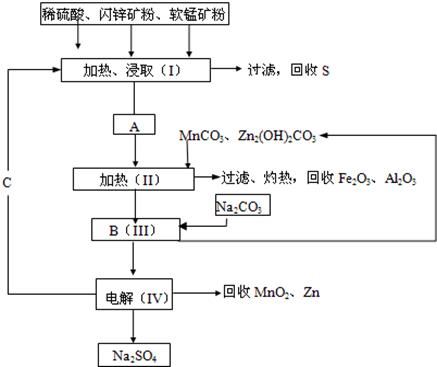
(1)A中属于还原产物的是 。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;Ⅱ需要加热的原因是 ;C的化学式是 。
(3)Ⅲ中发生的离子方程式为 , ;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 。
(1)MnSO4
(2)增大溶液的pH,使Fe3+和Al3+均生成沉淀;促进Fe3+、Al3+的水解;H2SO4
(3)Mn2++CO32-=MnCO3 2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑
(4)纯碱和硫酸
(1)由已知信息条件知,Mn元素化合价由+4价降低为+2价,民以A中还原产物为MnSO4;
(2)由工艺流程图知,MnCO3、Zn(OH)2CO3的作用就是调节pH,使Fe3+和Al3+均生成沉淀。Fe3+、Al3+沉淀容易形成胶体,不利于氢氧化铝、氢氧化铁沉淀,所以Ⅱ加热的目的是加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用。
(4)溶液B中含有Mn2+、Zn2+,根据流程图,加入Na2CO3后,生成MnCO3和Zn2(OH)2CO3,离子方程式是,Mn2++CO32-=MnCO3,2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑。
