(15分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)溴在周期表中位于第______周期第________族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是__________________________。
(3)步骤④利用了SO2的还原性,反应的离子方程式为________________________。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因____________________________________________________。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是____________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是_________________________________________。
(1)4 ⅦA (2)酸化可抑制Cl2、Br2与水反应 (3)Br2+SO2+2H2O===4H++2Br-+SO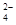
(4)温度过高,产生大量水蒸气,溴蒸气中水蒸气增加;温度过低,溴不能完全蒸出,吸收率低
(5)分液漏斗
(6)“空气吹出”、“SO2吸收”、“氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能更少,成本降低
题目分析:(1)35号元素溴在周期表中位于第四周期第ⅦA。(2)步骤①中用硫酸酸化可提高Cl2的利用率,是因为在酸性溶液中可以减少Cl2、Br2与水反应;(3)步骤④利用了SO2的还原性,反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO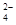 。(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,是因为温度过高,会产生大量水蒸气,溴蒸气中水蒸气含量增加;若温度过低,溴又不能完全蒸出,吸收率就会降低。(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离互不相溶的两层液体混合物的方法叫分液,分离仪器的名称是分液漏斗。(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,是因为“空气吹出”、“SO2吸收”、“氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能更少,成本降低,效益更高。
。(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,是因为温度过高,会产生大量水蒸气,溴蒸气中水蒸气含量增加;若温度过低,溴又不能完全蒸出,吸收率就会降低。(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离互不相溶的两层液体混合物的方法叫分液,分离仪器的名称是分液漏斗。(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,是因为“空气吹出”、“SO2吸收”、“氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能更少,成本降低,效益更高。