(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)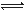 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。
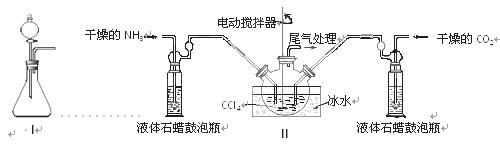
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
(每空2分)
(1)浓氨水与氢氧化钠固体等合理答案
(2)①降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);
通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率)
②过滤 c
(3)①
| 实验步骤 | 预期现象和结论 |
| 步骤3:少量澄清石灰水 | 溶液变浑浊 |
题目分析:⑴图I装置中没有加热,只能用浓氨水与氢氧化钠固体或氧化钙固体反应制取氨气。
⑵①据信息“该反应为放热反应、生成物氨基甲酸铵(NH2COONH4)受热易分解”,因此为了提高反应物的 转化率或防止产物的分解,可用冰水冷却发生器;气体通过液体石蜡鼓泡瓶时能观察气泡数,调节NH3与CO2通入比例或控制NH3与CO2的反应速率;
②根据“生成的氨基甲酸铵的小晶体悬浮在CCl4中”说明氨基甲酸铵难溶于CCl4(液体),采用过滤操作能将氨基甲酸铵从混合物中分离出来;为了防止氨基甲酸铵受热分解,采用“减压40℃以下”烘干产品。
⑶①在“限选试剂”中稀硝酸、稀盐酸与氨基甲酸铵、碳酸氢铵均能反应产生气体,不能用来验证碳酸氢铵;只有澄清石灰水与碳酸氢铵反应产生碳酸钙沉淀(溶液变浑浊);
②根据①可知产品的成分有NH2COONH4、NH4HCO3,与足量氢氧化钡溶液充分反应生成BaCO3沉淀的物质的量为n(BaCO3)= =0.01mol=n(NH4HCO3)[据碳原子守恒],则样品中氨基甲酸铵的物质的量分数为
=0.01mol=n(NH4HCO3)[据碳原子守恒],则样品中氨基甲酸铵的物质的量分数为 。
。

