现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
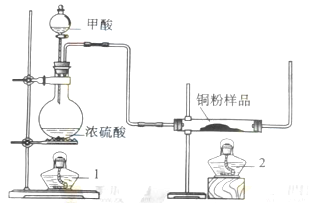
(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象时 ;
尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 。
(1)HCOOH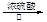 CO↑+H2O
CO↑+H2O
(2)铜粉中混合的氧化铜由黑色变成红色 CO、CO2
(3)a、c、b
(4)80%
(5)开放性试题,合理得分
(1)浓H2SO4使HCOOH脱水生成CO。(2)CO还原CuO生成红色的Cu。(3)为了不使生成的Cu被氧化,故需要继续通一会CO,所以先熄2处的酒精灯,为防止气体倒吸,故1处的酒精灯还需要加热,故先关闭分液漏斗。
(4)固体质量减少,即为CuO失去O原子,关系为“CuO ~ Cu” m
80 64 16
m(CuO) 5-4.8
得m(CuO)=1g,则样品中Cu的质量为5-1=4g,Cu的质量分数为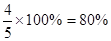 。(5)将样品溶于H2SO4,其中CuO被溶解,过滤出不溶物,洗涤、干燥、称得的质量即为Cu的质量。
。(5)将样品溶于H2SO4,其中CuO被溶解,过滤出不溶物,洗涤、干燥、称得的质量即为Cu的质量。
【考点定位】实验制备CO中实验的基本操作与现象,样品中含量的测定,实验方案的设计。
