(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
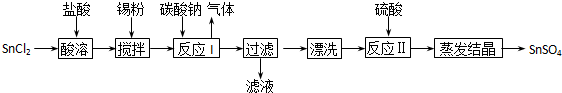
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol•L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
(1)抑制Sn2+水解 (2分) 防止Sn2+被氧化(2分)(2)Sn2+ + CO32-=SnO↓ + CO2↑(3分)
(3)取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净;(2分)
(4)小于1; (2分) (5)Sn2+ + H2O2 + 2H+=Sn4+ + 2H2O (3分)
题目分析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(2)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑;
(3)沉淀表面有吸附的氯离子,因此检验沉淀已经“漂洗”干净的方法是:取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明洗涤干净;
(4)根据 Ksp[Sn(OH)2]=1.0×10-26=c(OH-)2×c(Sn2+),将c(Sn2+)=1.0mol•L-1带人可得c(OH-)=10-13mol/L,c(H+)=0.1mol/L,故pH小于1,Sn2+完全沉淀;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O。
