(12分)硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
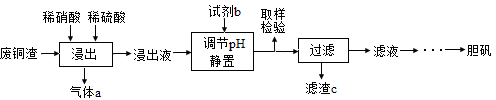
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 。
(3)滤渣c是 。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式: 。
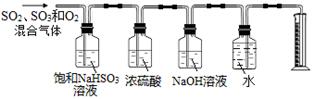
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由: 。
共12分。
(1)3Cu + 2HNO3 + 3H2SO4 =3CuSO4 + 2NO↑+ 4H2O(2分)
(2)向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净(2分)
(3)Fe(OH)3(2分)
(4)3NO2+H2O=2HNO3+NO(2分)
(5)3CuSO4 3CuO + SO3↑+ 2SO2↑+ O2↑(合理答案均可)(2分)
3CuO + SO3↑+ 2SO2↑+ O2↑(合理答案均可)(2分)
NaHSO3除了吸收SO3外和还吸收部分O2(合理答案均可)(2分)
题目分析:(1)根据氧化还原反应理论,铜与稀硫酸、稀硝酸的混合液反应生成硫酸铜、一氧化氮、水,化学方程式为3Cu + 2HNO3 + 3H2SO4 =3CuSO4 + 2NO↑+ 4H2O;
(2)Fe3+的检验方法是:向试样中滴加KSCN溶液,若溶液显红色,则Fe3+未除净,否则Fe3+除净;
(3)废铜渣中含有杂质铁,所以调节pH目的是使铁离子沉淀,则滤渣c是Fe(OH)3;
(4)气体a是NO,NO与氧气反应生成二氧化氮,二氧化氮溶于水又得硝酸和NO,化学方程式为3NO2+H2O=2HNO3+NO;
(5)硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,配平方程式得3CuSO4 3CuO + SO3↑+ 2SO2↑+ O2↑;饱和NaHSO3溶液不吸收二氧化硫,但可以与三氧化硫反应又生成二氧化硫,导致二氧化硫质量增大。
3CuO + SO3↑+ 2SO2↑+ O2↑;饱和NaHSO3溶液不吸收二氧化硫,但可以与三氧化硫反应又生成二氧化硫,导致二氧化硫质量增大。
