(本题共15分)碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜并测定产品产率的步骤如下:
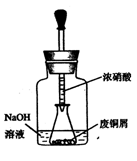
步骤一:废铜屑制硝酸铜
如图10,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L 的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:测定产品中碱式碳酸铜含量
1、灼烧,取n g样品,放入坩埚中充分灼烧
测定二氧化碳质量,
根据二氧化碳质量计算样品中碱式碳酸铜含量。
完成下列填空:
(1)步骤一上图装置中NaOH溶液的作用是 。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有 (填写化学式)。
(2)步骤二
①写出反应的离子方程式
②若调节pH大于8.5,制的产品的质量会 (填增大,减少,不变)
(3)步骤三中
①写出碱式碳酸铜分解方程式
②如何确定样品分解完全?
③补充完2中的实验步骤
④若实验测的样品中碱式碳酸铜含量大于100%,可能的原因是
(1)吸收氮氧化物 NaNO3 NaNO2
(2)CO32-+2Cu2++2OH-= Cu2(OH)2CO3 减少
(3) ① Cu2(OH)2CO3="=" 2CuO+CO2↑+H2O
②灼烧后冷却称量,连续两次质量不变
③使产生的气体依次通过盛有浓硫酸洗气瓶、碱石灰干燥管Ⅰ、碱石灰干燥管Ⅱ,称量碱石灰干燥管Ⅰ增重的质量即是二氧化碳质量。
④产品中含有碳酸铜杂质,干燥管吸收了二氧化碳和水等
题目分析:(1)铜与硝酸反应产生氮的氧化物,会污染空气,故应除去,氮的氧化物能与氢氧化钠反应,
NaOH+NO+NO2=NaNO2+ H2O 2NaOH+2NO2=NaNO2+ NaNO3+H2O
所以反应后溶液中含有NaOH、NaNO2、 NaNO3;
(2)pH值过高产生氢氧化铜杂质,导致产品质量减少;(3)样品分解产生二氧化碳和水蒸气,测定二氧化碳质量需先除掉水蒸气,同时防止空气中二氧化碳和水蒸气被碱石灰吸收;样品中碱式碳酸铜含量大于100%,说明干燥管Ⅰ质量增加偏大,可能是含有产生二氧化碳量更多的碳酸铜,也可能是水蒸气没被完全吸收而被干燥管Ⅰ吸收,或空气中二氧化碳、水等被干燥管Ⅰ吸收。
