某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠的含量,用如图所示装置.图中瓶乙盛饱和食盐水,瓶丙盛放浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)
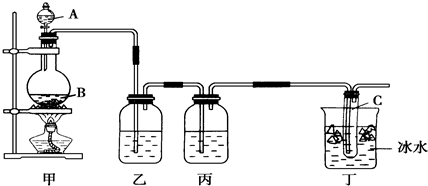
试回答:
(1)烧瓶B中盛______,试管C中盛______.
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置______(填“能”或“不能”),理由是______.
②装置丙是否有必要______(填“有”或“没有”),理由是______.
(3)有同学认为还必须加入某些装置,你认为怎样?______(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用______.
(4)丁装置中冰水的作用是______.
(1)根据实验装置可知,首先制备氯气,发生反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,则A中盛放浓盐酸,B中盛放MnO2,氯气和NaOH反应生成次氯酸钠,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,氯气经除杂后在C中和NaOH反应生成次氯酸钠,故答案为:MnO2;NaOH溶液; △ .
(2)①乙装置不能省略,可用来除去HCl,否则会消耗NaOH,降低NaClO的含量,
故答案为:不能;HCl气体进入C中,消耗NaOH,降低NaClO的含量;
②氯气与氢氧化钠溶液反应生成次氯酸钠,反应在溶液中进行,则没有必要除去氯气中的水蒸气,
故答案为:没有;少量水蒸气进入C中,不影响反应;
(3)氯气有毒,不能直接排放到空气中,应有尾气处理装置,
故答案为:需要;应加上尾气处理装置,防止Cl2污染空气;
(4)要提高次氯酸钠的含量,根据题意可知应在较低温度下反应,否则如温度过高则易生成NaClO3,
故答案为:防止Cl2与NaOH溶液在温度较高时,发生其他反应.
